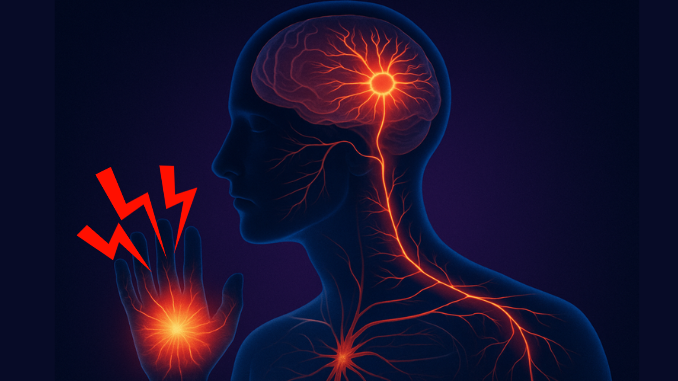
Una nuova ricerca, recentemente pubblicata su Nature, dimostra che è possibile ricostruire in laboratorio l’intero percorso che un segnale doloroso compie nel corpo umano, dalla periferia fino al cervello. Gli autori, guidati dal neuroscienziato Sergiu Pașca dell’Università di Stanford, sono riusciti a riprodurre in provetta quella che potremmo definire la “linea telefonica” del dolore: una catena di comunicazione che parte dalla pelle o dagli organi interni e termina nella corteccia cerebrale, dove il segnale viene percepito come una sensazione cosciente.
Per farlo, i ricercatori hanno utilizzato un tipo speciale di cellule, chiamate cellule staminali pluripotenti indotte (iPSC). Si tratta di cellule adulte, come quelle della pelle, che vengono riprogrammate per tornare a uno stato simile a quello embrionale. In questo stato primitivo, sono capaci di trasformarsi in quasi qualsiasi tipo di cellula presente nel corpo umano. A partire da queste iPSC, il team ha coltivato in laboratorio quattro strutture tridimensionali dette organoidi, piccoli “mini-organi” che mimano lo sviluppo e la funzione di tessuti reali.
Ogni organoide riproduceva una specifica tappa del circuito sensoriale: il primo conteneva neuroni simili a quelli dei gangli dorsali, che raccolgono segnali dalla periferia del corpo; il secondo imitava la parte dorsale del midollo spinale, dove i segnali vengono trasmessi e modulati; il terzo rappresentava il talamo, una sorta di centrale di smistamento delle informazioni sensoriali; il quarto riproduceva la corteccia somatosensoriale, l’area cerebrale che elabora le sensazioni tattili e dolorose.
Una volta accostati, questi quattro organoidi hanno iniziato a fondersi e a stabilire connessioni funzionali tra loro, dando vita a una nuova struttura più complessa, chiamata assembloide. Gli scienziati l’hanno chiamato hASA (human Ascending Somatosensory Assembloid). All’interno di questo mini-cervello modulare, i neuroni delle diverse regioni hanno iniziato a comunicare come in un circuito nervoso reale, permettendo di studiare – per la prima volta in un sistema completamente umano e controllabile – come uno stimolo doloroso si propaga e viene percepito lungo tutta la catena neurale.
Nel momento in cui i ricercatori hanno stimolato chimicamente la parte sensoriale dell’assembloide — cioè la regione che simula i neuroni in grado di ricevere stimoli dalla pelle o dagli organi — hanno osservato un’attivazione a cascata che percorreva tutte le altre strutture: dal midollo al talamo, fino alla corteccia. Questo ha confermato che le connessioni tra le quattro parti non erano soltanto anatomiche, ma funzionali. In altre parole, il circuito era vivo e operativo: un impulso sensoriale generava una risposta organizzata e coerente lungo l’intera catena neurale, proprio come accade nel corpo umano.
A rendere ancora più interessante il risultato è il fatto che questi segnali coordinati non erano presenti nei singoli organoidi isolati. Solo dopo l’unione in assembloide i neuroni iniziavano a mostrare una vera attività sincrona. Questo suggerisce che l’integrazione fra le diverse parti sia fondamentale per riprodurre i processi complessi della percezione sensoriale. Grazie a tecniche avanzate di imaging al calcio e registrazioni elettriche, gli autori hanno potuto osservare in tempo reale il modo in cui l’informazione attraversava il sistema, offrendo una finestra senza precedenti sull’attività dei circuiti neurali umani coinvolti nel dolore.
Il gruppo ha poi sfruttato questo mini-circuito per indagare il gene SCN9A, noto bersaglio dei disturbi di sensibilità al dolore. Quando SCN9A viene disattivato con CRISPR, la sincronia tra le quattro regioni quasi scompare, riproducendo in vitro l’insensibilità congenita al dolore. L’introduzione della variante iperattiva T1464I, associata a crisi di dolore estremo, produce l’effetto opposto: un’ipercorrelazione fra le aree, specchio di una rete diventata eccessivamente reattiva.
Oltre a dimostrare che il circuito funziona, hASA mette in luce differenze farmacologiche tra uomo e roditore. Per esempio, l’antagonista purinergico TNP-ATP, molto potente sui neuroni sensoriali murini, influenza appena quelli umani dell’assembloide, confermando che basarsi su modelli animali può portare a risultati fuorvianti nello sviluppo di farmaci contro il dolore, proprio perché i meccanismi biologici possono differire tra specie diverse.
Nel dettaglio, gli autori hanno evidenziato che:
- recettori sensoriali e canali ionici funzionano in modo diverso tra topi e umani;
- farmaci analgesici che sembrano promettenti nei roditori spesso falliscono nei trial clinici umani;
- la mancanza di un sistema umano integrato ha ostacolato finora lo sviluppo di terapie efficaci contro il dolore.
Il modello potrà essere ulteriormente perfezionato, per esempio includendo altre componenti del sistema nervoso o rendendo i neuroni sensoriali ancora più maturi. Ma le premesse sono chiare: per la prima volta, abbiamo a disposizione un circuito del dolore interamente umano, costruito in laboratorio, che ci consente di osservare come nasce, si propaga e viene percepito uno stimolo doloroso in un contesto rilevante per l’uomo. Uno strumento potente per capire meglio il dolore — e, in futuro, per imparare finalmente a combatterlo in modo più efficace.
Bibliografia
Kim, Ji., Imaizumi, K., Jurjuț, O. et al. Human assembloid model of the ascending neural sensory pathway. Nature (2025). https://doi.org/10.1038/s41586-025-08808-3