
Il diabete mellito di tipo 2 ha raggiunto proporzioni epidemiche in tutto il mondo e i modelli animali di diabete mellito umano vengono ampiamente utilizzati per studiare i meccanismi della malattia e per sviluppare nuovi farmaci. Negli ultimi tre decenni, i modelli murini di diabete di tipo 2 hanno prodotto oltre 50 pubblicazioni al mese; tuttavia, molti dettagli sulla patogenesi del diabete umano rimangono poco chiari, ostacolandone la prevenzione. Questo articolo, pubblicato sulla rivista scientifica Altex, indaga le ragioni di questa discrepanza traslazionale analizzando le prove sperimentali sui modelli murini di diabete di tipo 2. L’analisi ha rivelato importanti differenze specie-specifiche nella regolazione del glucosio a diversi livelli di complessità, da quello molecolare (espressione genica / proteine), a quello cellulare (segnalazione cellulare, recettori) a livello di tessuto /organo fino all’organismo intero ed all’interazione con l’ambiente (livello di popolazione). Lo studio è stato fatto confrontando i dati ottenuti sui roditori con i dati acquisiti usando cellule, tessuti, organi e popolazioni umane. Data l’ampia barriera interspecifica che crea un divario traslazionale immutabile, è urgente e necessario impiegare e sviluppare strategie di ricerca basate sulla biologia umana per poter progredire nella ricerca sul diabete di tipo 2.
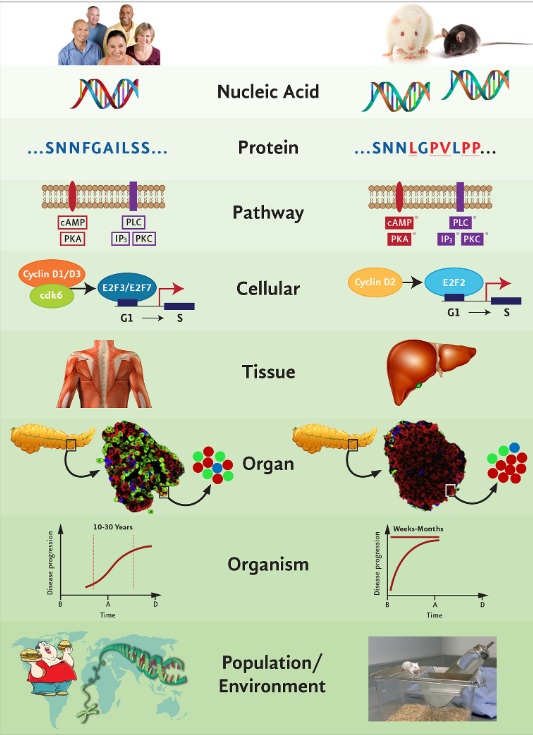
cellule rosse = cellule beta che secernono insulina, cellule verdi = cellule alfa che secernono glucagone, cellule blu = cellule delta che rilasciano somatostatina; (7) Livello di organismo intero – transizione progressiva dall’insulino-resistenza all’iperglicemia conclamata per un lungo periodo di tempo nell’uomo rispetto alla rapida progressione della malattia e al diabete di tipo 2 dalla nascita spesso osservata nei roditori (B=nascita, A=adulto, D=morte); (8) Livello ambientale: stile di vita incontrollato, fattori epigenetici nell’uomo rispetto ad ambienti di laboratorio controllati per i roditori. Fare riferimento al testo per ulteriori dettagli. cAMP: adenosina monofosfato ciclico; PKA: protein chinasi A; PLC: fosfolipasi C, IP3: inositolo trifosfato; PKC: proteina chinasi C, canale del potassio sensibile a KATP-ATP.
Chandrasekera PC, Pippin JJ. Of rodents and men: species-specific glucose regulation and type 2 diabetes research. ALTEX. 2014;31(2):157-76. doi: 10.14573/altex.1309231. PMID: 24270692.