Per decenni, la ricerca sulle dipendenze da sostanze – alcol, nicotina, cannabis, cocaina, metanfetamine e oppioidi – si è basata su modelli animali, soprattutto roditori. Questi modelli hanno permesso di descrivere i primi effetti delle droghe sul cervello, come la neuroinfiammazione o la riduzione della plasticità neuronale. Ma oggi la comunità scientifica riconosce che questi modelli hanno raggiunto un limite. Una recente review pubblicata su Drug Metabolism and Pharmacokinetics lo afferma senza mezzi termini: i modelli animali hanno esaurito la loro capacità di rispondere alle domande cruciali sulle dipendenze.
I limiti dei modelli animali
Le critiche raccolte dagli autori della review sono molteplici e decisive. La prima riguarda le differenze strutturali tra cervello umano e cervello dei roditori. L’espansione della corteccia, la complessità dei circuiti neuronali e i meccanismi di regolazione genica tipici dell’uomo non trovano corrispondenza negli animali da laboratorio. Questo significa che ciò che osserviamo in un topo difficilmente può essere trasferito a un paziente.
Non è un caso che tanti farmaci promettenti in fase preclinica abbiano fallito quando testati sull’uomo: la traduzione clinica dei risultati ottenuti sugli animali è spesso scarsa. A questo si aggiunge un problema metodologico: studiare il cervello animale vivo richiede tecniche invasive che, inevitabilmente, alterano lo stato fisiologico e comportamentale dei soggetti, introducendo variabili che confondono l’interpretazione dei dati.
Infine, ci sono i limiti etici e pratici. Alcuni aspetti delle dipendenze – ad esempio gli effetti dell’esposizione prenatale alle droghe – non possono essere studiati sugli esseri umani per ovvie ragioni etiche, ma non sono riproducibili neppure nei roditori, che hanno uno sviluppo cerebrale radicalmente differente dal nostro.
Gli organoidi cerebrali: una nuova via
È in questo scenario che entrano in gioco i cosiddetti organoidi cerebrali, o “mini-cervelli”: strutture tridimensionali generate a partire da cellule staminali umane, capaci di auto-organizzarsi e riprodurre in laboratorio processi chiave dello sviluppo cerebrale.
Questi “mini-cervelli” non sono copie perfette dell’organo reale, ma hanno caratteristiche che li rendono strumenti rivoluzionari: mostrano la diversità cellulare tipica del cervello umano, formano strati corticali e reti sinaptiche e permettono di studiare interazioni cellulari complesse che le colture bidimensionali non possono riprodurre. Soprattutto, consentono di osservare direttamente come l’esposizione a sostanze d’abuso influenzi lo sviluppo e la funzione neuronale in un contesto biologico autenticamente umano.
Cosa ci hanno insegnato finora
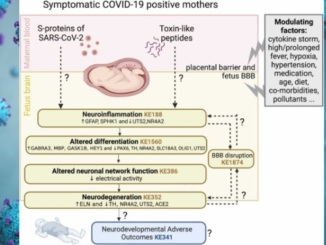
Gli studi passati in rassegna dalla review mostrano risultati concreti. L’esposizione degli organoidi all’alcol, ad esempio, provoca una morte cellulare dose-dipendente, con i neuroni più vulnerabili degli astrociti, e danneggia i mitocondri. Sono stati identificati anche geni regolatori, come EN2 e GABRG3, la cui espressione viene alterata dall’alcol, suggerendo un impatto diretto sui programmi di sviluppo neuronale.
Le metanfetamine, invece, innescano processi infiammatori: gli astrociti diventano reattivi, si osservano apoptosi e stress ossidativo, e vengono coinvolti geni immediati come FOS e JUN. La cocaina agisce soprattutto sui circuiti dopaminergici: in organoidi e “assembloidi” (che combinano più regioni cerebrali) si osservano un aumento delle terminazioni dopaminergiche e alterazioni della plasticità neuronale che persistono anche dopo la sospensione della sostanza.
Anche le droghe considerate “più leggere” mostrano effetti pesanti. La nicotina, in modelli di organoidi su chip, accelera in maniera anomala la differenziazione dei neuroni e disorganizza la formazione delle regioni cerebrali, mentre il THC riduce i recettori CB1 e ostacola la maturazione neuronale, rallentando la crescita dei neuriti. Infine, gli oppiacei stimolano la microglia (il sistema immunitario del cervello) e scatenano una cascata infiammatoria mediata da citochine come IL-1β e TNF-α, un meccanismo che richiama da vicino ciò che avviene nei cervelli di persone dipendenti.
Queste osservazioni mostrano come gli organoidi riescano a riprodurre fedelmente, a livello cellulare e molecolare, i danni provocati dalle sostanze d’abuso nel cervello umano, offrendo un modello che va molto oltre le possibilità degli animali.
Uno sguardo al futuro
Gli organoidi cerebrali stanno diventando sempre più sofisticati. Le nuove tecniche di biostampa 3D e microfluidica permettono di creare organoidi vascolarizzati, meno soggetti a necrosi e ipossia, mentre gli “assembloidi” consentono di studiare le connessioni tra diverse aree cerebrali. Inoltre, si parla già di “chimeroidi”, organoidi generati da cellule staminali di diversi donatori, per esplorare la variabilità individuale nella vulnerabilità alle droghe.
Secondo gli autori della review, questi sviluppi aprono la strada a un vero e proprio cambio di paradigma: lo studio delle dipendenze non deve più dipendere da modelli animali inadeguati, ma può finalmente basarsi su modelli umani realistici. Gli organoidi non solo aiutano a capire meglio i meccanismi molecolari delle droghe, ma permettono di identificare vulnerabilità genetiche ed epigenetiche e di progettare terapie mirate, fino a immaginare approcci personalizzati per la prevenzione e il trattamento delle dipendenze.
Gli organoidi cerebrali umani sono ancora a uno stadio iniziale: non riescono a riprodurre tutti i sei strati corticali, mancano di alcuni tipi cellulari non neuronali, mostrano variabilità tra campioni, hanno connettività e circuiti immaturi e regioni spesso disorganizzate. Tuttavia, nonostante queste limitazioni, il loro potenziale resta enorme e, qualora la ricerca in tale ambito venga adeguatamente finanziata e promossa, potrebbero aprire un nuovo capitolo nello studio e nel trattamento delle dipendenze.
Bibliografia
Li K, Gu L, Cai H, Lu HC, Mackie K, Guo F. Human brain organoids for understanding substance use disorders. Drug Metab Pharmacokinet. 2024 Jul 26;58:101031. doi: 10.1016/j.dmpk.2024.101031. Epub ahead of print. PMID: 39146603.