“La ricerca preclinica così come è stata condotta fino ad oggi (basata sui modelli animali e su quelli in vitro di vecchia generazione) ha fallito la sua missione di fornire risposte migliorative per la salute umana. Questo tipo di ricerca, perseguendo in forma eccessiva il riduzionismo, ha puntato la massima attenzione sul singolo gene o proteina, tralasciando che la malattia di Parkinson è una condizione umana di maggiore complessità e ad eziologia multifattoriale.“
Il Parkinson è la seconda malattia neurodegenerativa per diffusione dopo il morbo di Alzheimer; si stima che le persone affette da PD (Parkinson disease) siano 10 milioni in tutto il mondo e le previsioni sono di raddoppio dei pazienti entro il 2040.
Nonostante i numerosi sforzi compiuti a livello scientifico, nessun trattamento realmente efficace a lungo termine è stato ancora trovato. Dal 1990 al 2018 si contano circa 23.000 studi condotti su animali, di cui circa un 10% in primati non umani. In generale per mimare le condizioni in vivo tipiche del PD si è provveduto a indurre la malattia negli animali o a modificarli geneticamente, tuttavia con scarsi risultati. La fallacia della trasferibilità dei risultati ottenuti su questi modelli all’ uomo è all’origine dei mancati progressi nella scoperta di terapie efficaci. Oggi abbiamo a nostra disposizione le metodologie alternative basate su tecnologie di ricerca human-based, che possono consentirci davvero di fare luce e chiarezza sui meccanismi patogenetici all’origine della malattia, sugli sviluppi e sui possibili approcci terapeutici. Un workshop dedicato proprio alla ricerca sul morbo di Parkinson ha messo in luce ciò che sappiamo, cosa stiamo cercando e cosa c’è ancora da fare. In primo luogo viene sottolineato come benchè l’attenzione sia stata puntata da sempre solo sul sistema nervoso centrale, le cause della malattia potrebbero risiedere anche altrove, ovvero nel sistema nervoso autonomo, periferico e nel microbiota intestinale. Un altro importante rilievo è quello inerente la progressività nell’insorgenza e l’origine più spesso multi-fattoriale della malattia. La mancata scoperta dei meccanismi molecolari alla base del processo degenerativo, rappresenta uno dei
principali ostacoli alla realizzazione di terapie efficaci. La componente genetica, benché importante, è coinvolta solo nel 10-15% dei casi di malattia. Per molto tempo si è ritenuto che l’aggregazione dell’alfa-sinucleina fosse essenziale nella patogenesi della malattia, ma così non è. Si è infatti scoperto che i corpi di Lewy (aggregati citoplasmatici delle proteina alfa-sinucleina, presenti nelle cellule neurali) possono essere assenti in pazienti con PD e viceversa presenti anche in pazienti che non hanno sviluppato sintomi né di PD né di demenza. Dunque dopo moltissimo tempo dalla scoperta dei corpi di Lewy, ancora non sappiamo come la alfa-sinucleina divenga tossica dando seguito allo sviluppo delle sinucleinopatie, tra cui il PD. A questo proposito molte evidenze sembrerebbero suggerire che alterazioni post traduzionali della proteina, potrebbero portare a una sua forma denaturata in grado di spostarsi da un neurone all’altro e con attività aggregativa simil prionica.Vediamo ora tutto quanto è già disponibile per lo studio del PD utilizzando nuovi approcci metodologici (NAMs) senza animali:
- Cellule LHUMES ovvero cellule precursori embrionali neuronali umane, in grado di proliferare e differenziarsi in cellule neuronali dopaminergiche morfologicamente e biochimicamente mature; dalla cocultura di queste cellule con astrociti è stato possibile identificare il meccanismo di attivazione del pesticida MPTP (1-metil 4-fenil 1,2,3,6-tetraidro-piridina) in grado di causare una sintomatologia analoga a quella causata dal PD; i limiti sono dati soprattutto dalla bidimensionalità, che non consente di ricapitolare adeguatamente tutti gli aspetti meccanici e fisiologici presenti in vivo e dal mantenimento in vita delle cellule;
- Organoidi di cervello strutturati a partire da cellule embrionali, da staminali pluripotenti indotte o altri tipi di cellule, che hanno la caratteristica di essere tridimensionali potendo così ricapitolare in modo molto più efficace le caratteristiche in vivo del tessuto. Sono presenti neuroni, astrociti e oligodendrociti con attività elettrofisiologica. Da sottolineare come lo sviluppo di organoidi a partire da cellule IPSC (staminali pluripotenti indotte) derivanti da pazienti con PD, consenta di studiare in modo specifico la malattia affrontando le differenze genetiche individuali, quelle tra i generi e approntando terapie mirate; organoidi di mesencefalo, prodotti a partire da cellule di pazienti con PD a base genica, hanno evidenziato la presenza di un numero ridotto di astrociti, confermando coerentemente a quanto visto nel cervello umano, che la morte dei neuroni dopaminergici si associa a quella degli astrociti; in questo caso i fattori limitanti sono rappresentati dall’assenza di una vascolarizzazione e nella crescita troppo scomposta delle cellule;
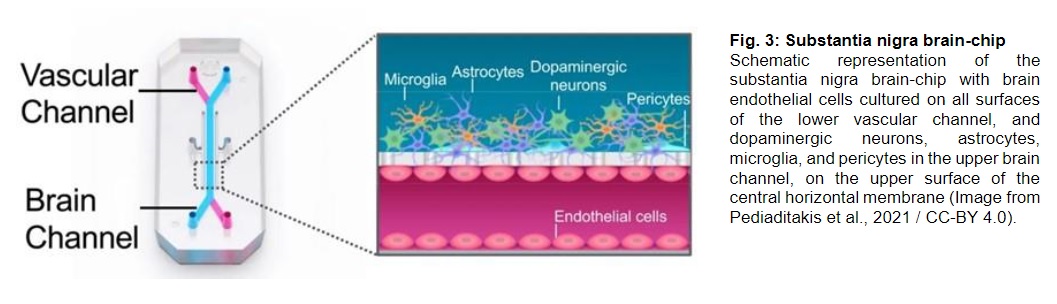
- Organi on-chip, in questo caso ne è stato prodotto uno di cervello umano rappresentativo della substantia nigra mesencefalica a partire da cellule iPSC derivate da neuroni dopaminergici, microglia immortalizzata, astrociti primari, periciti primari e cellule iPSC derivate da cellule endoteliali vascolari neuronali. Si è così potuto testare gli effetti degli aggregati della alfa-sinucleina su un modello in grado di ricapitolare molti aspetti cruciali della PD come l’accumulazione dell’alfa-sinucleina fosforilata, l’assorbimento delle fibrille di alfa sinucleina da parte dei neuroni, degli astrociti e delle cellule della microglia, le disfunzioni mitocondriali, la produzione di specie reattive dell’ossigeno (ROS), la neuroinfiammazione, la morte delle cellule neurali e l’alterazione della barriera ematoencefalica. Da sottolineare come le indagini di trascrittomica condotte sulle cellule endoteliali prelevate dal modello su chip, abbiamo rilevato una maggior espressione di geni coinvolti nei processi infiammatori, nello stress ossidativo, nell’autofagia (rimozione di componenti citoplasmatici danneggiati) e nella deposizione di matrice extracellulare. Nel contempo si assiste invece a una down regulation dei geni che codificano per le giunzioni proteiche serrate, suggerendo così nuovi spunti sia di patogenesi sia di approccio terapeutico;
- Le scienze omiche, rappresentate dalla genomica, dalla proteomica, dalla trascrittomica e dalla metabolomica, hanno un ruolo fondamentale e ciascuna è in grado di approfondire elementi salienti per l’individuazione della patogenesi, della diagnosi e della terapia. Consentono di individuare i diversi pattern genetici associati alla forme di malattia, di studiare le proteine che si formano durante la degenerazione, nonché di caratterizzare l’espressione genica delle cellule, etc;
- Tecniche di imaging avanzate come la PET (tomografia ad emissione di positroni), la MRI (risonanza magnetica), la fMRI (risonanza magnetica funzionale), l’ecografia transcranica, la magnetoencefalografia e ancora la PMRS (spettroscopia con tecnica di risonanza magnetica protonica) sono già ora di grande importanza, sia per la diagnostica che per la clinica. Sicuramente queste tecniche spesso piuttosto onerose, necessitano di adeguata implementazione al fine di conferire loro maggiore accuratezza e specificità soprattutto nel correlare la notevole massa dei dati ricavati, con gli aspetto patogenetici o clinici tipici della malattia. Da sottolineare l’uso già in essere di traccianti PET per discriminare la PD da altre patologie con sintomi analoghi come l’atrofia multi sistemica e lo studio per individuare traccianti dell’alfa-sinucleina;
- Metodi computazionali, svolgono un ruolo importante nell’affrontare una sfida spesso sottovalutata, quella del passaggio dalla fase preclinica a quella clinica di un potenziale farmaco. Il sistema QSP è un nuovo modello di test che mira a valutare la farmacodinamica e il potenziale terapeutico di nuovi composti, tenendo in considerazione le caratteristiche individuali del paziente. Questo, nel caso specifico della PD, si è tradotto nella formulazione di modelli meccanicistici e di biologia di interazione tra un composto e un circuito neurale, per simulare gli effetti farmacodinamici di un farmaco in relazione al genotipo specifico del paziente, alle terapie concomitanti e alle malattie presenti.
La ricerca preclinica così come è stata condotta fino ad oggi (basata sui modelli animali in vivo e su quelli in vitro di vecchia generazione) ha fallito la sua missione di fornire risposte migliorative per la salute umana. Questo tipo di ricerca, perseguendo in forma eccessiva il riduzionismo, ha puntato la massima attenzione sul singolo gene o proteina, tralasciando che la PD è una condizione umana di maggiore complessità e ad eziologia multifattoriale. La strada è tracciata, ma per far si che si possa progredire nella sostituzione definitiva dei test sugli animali, c’è bisogno di informazioni e dati scientifici liberamente accessibili, di finanziamenti e di una forma mentis che senza avere paura di mettersi in gioco, sappia porsi innanzi a dati e modelli in modo più innovativo.
Cassotta, M. et al. “The future of Parkinson’s disease research: A new paradigm of human-specific investigation is necessary… and possible”, ALTEX – Alternatives to animal experimentation. 2022. doi: 10.14573/altex.2203161.