Un’interessante ricerca ha esaminato lo stato attuale dei modelli di ricerca basati su organs-on-chip, evidenziando tutti i traguardi raggiunti nelle diverse branche di ricerca (ricerca di base, tossicità, etc), e con un occhio a quanto ancora deve essere fatto per far si che gli organs on-chip non siano solo sostitutivi ai modelli tradizionali (in vitro ed in vivo) ma anche migliorativi, per una ricerca altamente specializzata e personalizzata. Dagli iniziali tessuti in 2D che mal si prestavano alla corretta riproduzione delle caratteristiche in vivo, si è giunti sino ai tessuti 3D ingegnerizzati volti a ricostituire i tessuti di uno più organi miniaturizzati; dalle forme iniziali con modelli statici, si è poi passati ai sistemi microfluidici che hanno consentito di ricapitolare con precisione e puntualità i meccanismi fisiologici e biochimici che si verificano in vivo. Sono dunque state create nei diversi organi delle interfacce utili a mimare quanto avviene in vivo in un alveolo, presso un tubulo renale, presso un sinusoide epatico etc.
Altro aspetto fondamentale è stato l’inserimento in sito delle cellule del sistema immunitario, che rappresentano da sempre una componente fondamentale nello sviluppo dei processi morbosi. Vediamo alcuni degli impieghi degli organs on-chips:
- Organs on-chip di polmone: studio dei meccanismi edemigeni indotti dalla somministrazione dell’antitumorale IL-2; studio dei meccanismi di citotossicità in risposta alle nanoparticelle di ossido di zinco; studio della trombosi indotti dal LPS (lipopolisaccaride); ancora studio di forme asmatiche e della COPD (malattia cronica ostruttiva polmonare); della fibrosi cistica, del cancro, delle infezioni da SARS-CoV-2 e da vari ceppi virali dell’influenza A. In riferimento al SARS-CoV-2, le ricerche sugli organs on-chip di polmone hanno confermato quanto già visto nella pratica clinica: ad esempio l’antivirale remdesivir è in grado di bloccare la replicazione virale e alleviare i danni alla barriera epitelialeendoteliale; mentre gli antimalarici clorochina e idrossiclorochina non sono risultati efficaci.
- Organs on-chip di fegato: studio dell’epatotossicità, del metabolismo e delle interazioni farmacologiche, delle infiammazioni e delle infezioni. Studi di interazione farmacologica sull’attività enzimatica, studi inerenti la variabilità di risposta tra soggetti diversi, studi su patologie virali come l’epatite B. Da sottolineare la presenza nei modelli di cellule parenchimali epatiche, di cellule endoteliali sinusoidali, di cellule di ito e di cellule del sistema macrofagico, come quello di kupfer.
- Organs on-chips di intestino: fondamentale in primis lo studio del ruolo giocato dalla mobilità meccanica in tutte le risposte operate dalla mucosa; altrettanto importante è l’integrazione con le diverse specie batteriche presenti in sito, che hanno un ruolo così decisivo nei diversi processi biochimici.
- Organs on-chips di linfonodo: in questo caso si è ricostruito a partire da cellule germinali periferiche, un modello di linfonodo con all’interno sia linfociti B che linfociti T. Non solo, si è provveduto poi all’inserimento di cellule presentanti l’antigene, che in presenza di opportuna stimolazione antigenica hanno determinato l’attivazione dei linfociti B a plasmacellule e altresì la produzione citochinica. Si è inoltre provveduto a testare terapie immunologiche su frammenti di tessuto derivanti da pazienti con patologia tumorale; lo scopo era esaminare il funzionamento specifico in sito e i limiti che si frappongono al raggiungimento di strategie decisive nella soppressione della forma cancerogena in atto.
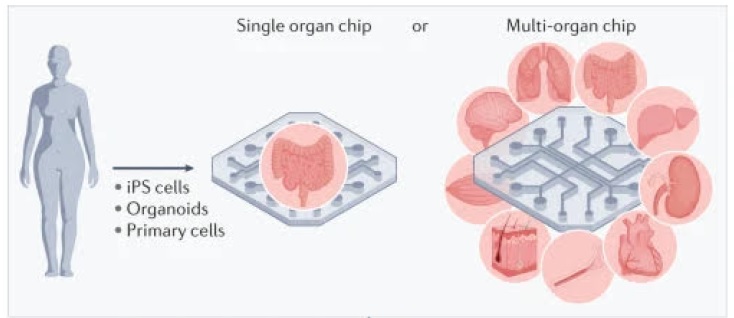
Oggi esistono modelli on-chip di tantissimi organi: reni, cervello, occhio, osso, organi riproduttivi (chip di placenta e di ghiandola mammaria), vasi sanguigni, organi linfoidi, ecc.
Ma sono i sistemi multi-organo, che in virtù della loro capacità di interconnettere tra loro i singoli organi, ci consentono di mimare le diverse interazioni e i diversi effetti che seguono l’assunzione o la somministrazione di un farmaco. E dunque è possibile con questi sistemi avere un modello della farmacocinetica e della farmacodinamica della sostanza in uso, che rappresentano elementi imprescindibili non solo per capire, ma altresì per approntare la terapia.
Come mai allora il loro uso non è ancora universalmente riconosciuto?
- Necessità di validare e riconoscere i metodi;
- Frammentazione nell’uso;
- E’ fondamentale che tutti riconoscano l’impossibilità di sostituire i modelli animali in un modo qualunquistico, e la necessità che ciò avvenga tramite la definizione di organs on-chip specificatamente strutturati per singoli approcci di studio, ovvero formati per rispondere a domande di farmacocinetica/farmacodinamica e volti a misurare l’efficacia dei farmaci o in alternativa il loro profilo di sicurezza;
- Altrettanto importante è utilizzare per lo studio di una patologia l’organ on-chip meglio configurato a ricreare le condizioni in vivo (le affezioni che colpiscono gli stessi organi lo fanno spesso in modo del tutto differente, dunque ad esempio se vogliamo studiare l’edema polmonare, avremo necessità di un modello dotato di epitelio alveolare ed endotelio, diversamente se vogliamo studiare la fibrosi polmonare necessiteremo della componente fibroblastica).
Quale sarà il contributo al futuro della ricerca?
- I modelli di organs on-chip potrebbero essere utilizzati per rispondere a tutte quelle domande che vanno ben oltre la mera sostituzione dei test condotti su animali. Consentendo ad esempio di identificare l’origine della tossicità parziale osservata in certi gruppi di individui, durante i trial di fase I o ancora le differenze riscontrate nella risposta uomo-donna, piuttosto che in sottogruppi geneticamente simili. Nello stesso tempo la capacità di replicare questi fenomeni di tossicità specifica, si tradurrebbe nella possibilità di sperimentare composti alternativi a quelli di uso comune;
- Potrebbe avere la sua utilità, almeno nella fase iniziale, la produzione di organs on-chip a partire da cellule animali. Potrebbe consentire a coloro che da sempre operano su modelli animali, uno step di passaggio a metodiche costituite da organs on-chip esclusivamente umani;
- Ma il vero traguardo è rappresentato non solo dal superamento dei modelli animali, quanto dalla capacità che i modelli human based siano in grado di replicare quanto avviene nella clinica umana;
I costi per approntare questo tipo di modelli sono ancora considerevoli. Nel contempo alcune valutazioni approntate da alcune case farmaceutiche hanno mostrato che l’adozione di questi modelli di ricerca, porterebbe in ultimo ad un risparmio economico che si aggira intorno al 25% dei costi investiti in ricerca e sviluppo.
La FDA ha fatto partire il progetto pilota ISTAND (Innovative Science and Technology Approaches for New Drugs) che consente la qualificazione dei modelli di organs on-chip e una corsia preferenziale per la loro validazione.
Gli organs on-chip potrebbero rispondere a tutte le domande inerenti le diversità di genere, quelle esistenti tra adulti e bambini, quelle presenti in gravidanza e ancora quelle di individui appartenenti a gruppi genetici distinti; nonché simulare la presenza di comorbidità e la possibilità di testare sostanze con potenziale tossico sconosciuto.
Ingber DE. Human organs-on-chips for disease modelling, drug development and personalized medicine. Nature Reviews Genetics (2022). https://www.nature.com/articles/s41576-022-00466-9